De FDA heeft besloten om het experimentele mRNA-griepvaccin van Moderna alsnog te beoordelen, nadat de aanvraag eerder werd afgewezen. Deze koerswijziging opent de deur voor mogelijke goedkeuring vóór het komende griepseizoen, met een besluit verwacht op 5 augustus. Het vaccin is strategisch belangrijk voor Moderna’s groei en de ontwikkeling van gecombineerde Covid- en griepvaccins.
De herziening volgt op een aangepaste aanvraag van Moderna die beter aansluit bij de eisen van de toezichthouder.
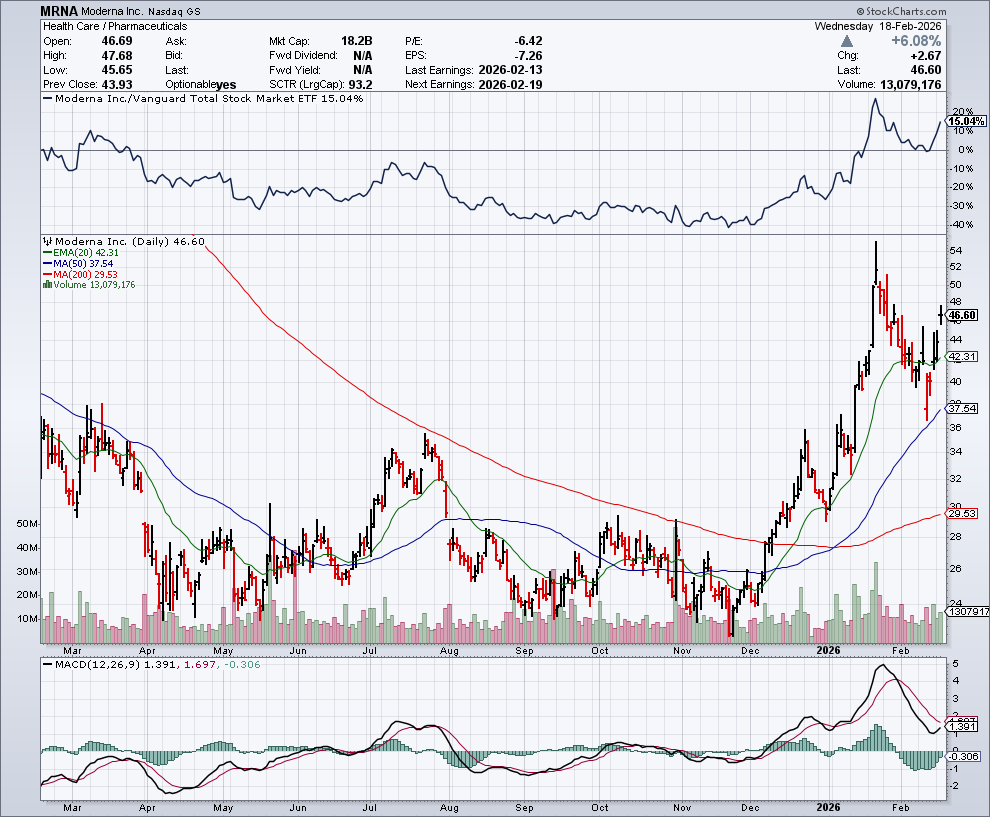
In de onderstaande grafiek zien we het koersverloop van Moderna, dat hoger sprong door het nieuws:
Aangepaste aanvraag gericht op oudere risicogroepen
Moderna heeft een nieuwe goedkeuringsstrategie voorgesteld na overleg met de FDA. Het bedrijf vraagt volledige goedkeuring voor volwassenen van 50 tot 64 jaar.
Daarnaast vraagt het versnelde goedkeuring voor mensen van 65 jaar en ouder, met aanvullende studies na marktintroductie.
De FDA had eerder kritiek op de onderzoeksopzet van Moderna’s fase 3-studie, de toezichthouder vond dat de vergelijking met een standaard griepvaccin onvoldoende was voor oudere volwassenen.
Moderna paste daarop zijn aanvraag aan om beter aan de eisen te voldoen.
Na het nieuws steeg het aandeel Moderna met meer dan 6%. CEO Stéphane Bancel verklaarde dat het bedrijf het vaccin later dit jaar beschikbaar wil maken, mits goedgekeurd.
Goedkeuring cruciaal voor toekomstige groei
Het griepvaccin speelt een sleutelrol in Moderna’s bredere mRNA-strategie. Het bedrijf wil deze technologie ook toepassen op andere ziekten, waaronder kanker en infectieziekten.
Succesvolle goedkeuring kan helpen om de omzet te stabiliseren na de daling van Covid-vaccinverkopen.
De FDA benadrukte dat mRNA-technologie veel potentieel heeft, maar moet voldoen aan strikte wetenschappelijke normen. De komende beslissing kan daarom bepalend zijn voor het vertrouwen in toekomstige mRNA-toepassingen.
Bron: CNBC
Foto: iStock